В.
В. Бородин "Защита автомобиля от коррозии электрохимическим способом"
1. Механизм корозии корпуса автомобиля.
2. Корозия автомобиля во время эксплуатации и пассивные
методы борьбы с ней.
3. Корозия автомобиля на открытой стоянке.
4. Корозия автомобиля при хранении в гараже.
5. Корозия движущегося автомобиля.
6. Протекторная защита от корозии.
7. Электрохимическая защита от корозии.
8. Устройство для электрохимической защиты кузова
автомобиля от корозии.
9. Правила установки и эксплуатации устройства.
10.
Электрохимическая
защита.
11.
Защита
поврежденных в результате аварии частей кузова.
12.
Заключение
Приложения.
13.
Приложение 1.
Скрытые полости автомобиля.
14.
Приложение 2.
Использование защитных покрытий для предотвращения корозии кузова автомобиля.
МЕХАНИЗМ КОРРОЗИИ КОРПУСА АВТОМОБИЛЯ
Прежде чем пытаться защититься от коррозии,
необходимо ответить на вопрос о том, что же такое коррозия металла. В обиходе
коррозией называют появление ржавчины на поверхности металла. Каковы же
основные механизмы появления ржавчины?
Необходимо признать, что до настоящего времени полного ответа на этот вопрос
нет, а результаты проводимых исследований показывают, что процесс коррозии
является очень сложным, поскольку на его протекание оказывает влияние большое
число факторов — химический состав металла среда, в которой он находится
температура давление наличие газов и т.д. По этой причине в книге изложены
только самые начальные сведения из теории коррозии, знание которых необходимо
для правильной защиты корпуса автомобиля. Более полное представление о
механизмах коррозии читатель может почерпнуть из рекомендуемой литературы.
Коррозия железа (а именно этот процесс мы будем рассматривать в дальнейшем)
осуществляется, если дополнительно имеются, по крайней мере, еще две
составляющие электролит, с которым граничит железо, и другой проводник, также
граничащий с электролитом. Электролитом в обычных условиях является дождевая
вода атмосферная влага снег, дорожная грязь. Вторым, по отношению к кузову
автомобиля проводником чаще всего является поверхность земли, атмосфера, какой
либо другой внешний проводник, расположенный вблизи автомобиля. Два проводника
(которые в данном случае называются электродами) погруженные в электролит
образуют так называемый гальванический элемент. Основное свойство
гальванического элемента состоит в том, что если электроды выполнены из
различных металлов, то такой элемент является источником напряжения. При этом
положительный, электрод называется анодом отрицательный — катодом.
Проделайте простой эксперимент. В стакане теплой воды растворите ложку
поваренной соли и опустите две пластины — одну медную другую стальную.
Простейший источник напряжения готов. С помощью вольтметра можно легко
убедиться в том, что гальванический элемент создает небольшое менее полувольта
напряжение. Если вы продолжите эксперимент несколько дней, то заметите как на
поверхности стали начнет появляться ржавчина Этот простой эксперимент наглядно
демонстрирует механизм коррозии металла. Объяснение этого механизма состоит в
следующем.
Из курса физики известно, что проводники характеризуются способностью отдавать
электроны во внешнюю среду. Наглядно можно представить, что каждый проводник
окружен облаком из электронов, которые под действием тепловой энергия вылетают
из него, а затем, если им ничто не мешает, под действием электрических сил
возвращаются в проводник. Если металл поместить в электролит, то положительные
ионы металла (т.е. те атомы металла, электроны которых находятся во внешней
среде) начнут переходить в электролит. В результате этого металл приобретает
некоторый потенциал, который может быть измерен. На практике потенциал металла
определяют по отношению к специальному стандартному электроду потенциал
которого принимается равным нулю. Полученная разность потенциалов между
стандартным электродом и металлом получила название стандартного электродного
потенциала (СЭП).
Ниже приведены стандартные электродные потенциалы некоторых металлов,
расположенные в порядке снижения их активности, т.е. чем более отрицательным
является СЭП тем выше активность металла.
Стандартные электродные потенциалы
металлов, В
|
Магний |
-2,38 |
Танталл |
-0,34 |
|
Алюминий |
-1,66 |
Никель |
-0,24 |
|
Марганец |
-1,18 |
Молибден |
-0,2 |
|
Хром |
-0,91 |
Свинец |
-0,13 |
|
Цинк |
-0,76 |
Медь |
0,34 |
|
Железо |
-0,44 |
Серебро |
0,8 |
|
Кадмий |
-0,4 |
|
|
Наибольший интерес представляет процесс
коррозии железа в электролите при наличии менее активного металла. В этом
случае железо как более активный металл является анодом а менее активный — катодом.
В гальванической паре всегда корродирует более активный металл — анод.
Коррозия анода сопровождается двумя видами реакций — окислительной на аноде и
восстановительной на катоде. В дальнейшем для определенности в качестве анода
рассмотрим железо (Fe), однако все результаты относительно его коррозии
справедливы, по крайней мере качественно для любого ранее названного металла.
Окислительная реакция может быть представлена как процесс при котором атомы
железа отдают два электрона и вследствие этого превращаются в положительно
заряженные ионы железа (Fе2+), которые переходят в раствор
электролита в месте контакта его с анодом. Указанные два электрона сообщают
аноду отрицательный заряд и тем самым вызывают ток по направлению к катоду, где
соединяются с положительными ионами. Одновременно положительные ионы анода
соединяются с отрицательно заряженными гидроксильными группами (ОН ), которые
всегда присутствуют в растворе электролита.
Схематически реакция на аноде может быть записана в следующем виде:
Fe +
20Н- = Fe2+ + 2е + 20Н- = Fe(OH)2 +
2е.
Под действием ионов железа на катоде
возникают ионы водорода (Н+), с которыми и соединяются электроны
анода. Схематически этот процесс описывается в следующем виде:
Н+
+ 2е = 2Н = Н2
т.е. на катоде происходит выделение водорода.
Если анодная и катодная реакции объединяются, они приводят к общей реакции
коррозии
Fе +
2Н20 = Fе(ОН)2 + Н2
Таким образом, железо в сочетании с водой и
менее активным металлом переходит в гидроокись железа, которая в обиходе и
называется ржавчиной.
Наличие в воде дополнительной соли приводит к повышению проводимости
электролита и, как следствие, к увеличению скорости окисления анода. При этом
дополнительно образуются хлорное железо и раствор соляной кислоты. Вот такие
условия создают автолюбителям каждую зиму наши дорожники. Впрочем, кислотные
дожди, которые выпадают с осадками, также не способствуют долголетию
автомобиля.
Важной характеристикой коррозии является скорость коррозии, которая
определяется как глубина проникновения коррозии в металл в единицу времени. Для
железа наиболее характерным является значение скорости коррозии в пределах
0,05—0,02 нм/год. Из приведенных значений скорости коррозии следует, что при
нарушении лакокрасочного покрытия за 5 лет эксплуатации автомобиля толщина металла
может уменьшиться на 0,25—1 мм, т е., по сути дела, если не предусмотреть
специальных мер защиты, металл проржавеет, что называется, насквозь.
Описанный механизм коррозии указывает также на основные пути борьбы с этим
явлением. Кардинальный путь состоит в устранении катода или электролита,
однако, этот способ и наименее пригоден, поскольку автомобиль не может быть
изолирован от окружающей среды и, в частности, от поверхности земли. Остаются
два пути — изолировать металл от электролита с помощью покрытия или превратить
корпус автомобиля из анода в катод.
Первый способ известен всем автолюбителям и широко используется на практике,
однако он не прекращает коррозии как таковой, а только защищает металл от
ржавления. При нарушении лакокрасочного покрытия коррозия начинается разъедать
металл, а повторное нанесение покрытия сопряжено с большими временными и
материальными затратами (прил. 1, 2).
Наиболее уязвимыми частями корпуса автомобиля при этом являются скрытые полости
и щели, такие, как пороги, внутренние балки, лонжероны, стойки, внутренние
поверхности дверей, потолок, да практически весь корпус автомобиля (см. прил.
1). Сложная форма скрытых щелей и полостей затрудняет, а чаще делает
невозможным качественную подготовку поверхности под окраску и саму окраску, а
внутренние напряжения изогнутого в этих местах металла способствуют его
интенсивной коррозии. В этих условиях срок службы кузова легкового автомобиля
до выхода его из строя составляет 6 лет.
Вместе с тем, не отрицая важности регулярного восстановления лакокрасочного
покрытия, автор обращает внимание на принципиально иной метод защиты корпуса
автомобиля от коррозии, а именно, полное прекращение самого процесса коррозии
путем изменения потенциала корпуса. Этот метод в литературе называется катодной
защитой.
Катодная защита металлов основана на том, что скорость коррозии пропорциональна
активности металлов, образующих гальваническую пару. В обычных условиях корпус
автомобиля является анодом и поэтому корродирует. Если же изменить потенциал
корпуса относительно внешней среды либо с помощью внешнего источника напряжения
либо приведя в контакт с более активным металлом, то сам корпус автомобиля
станет катодом и корродировать вообще не будет (по крайней мере скорость
коррозии уменьшится в сотни раз), а разрушаться станет анод. В соответствии со
способом изменения потенциала защищаемого металла различают протекторную и
электрохимическую защиту. Однако прежде чем рассматривать методы защиты,
целесообразно описать особенности коррозии автомобиля в различных условиях его
эксплуатации.
КОРРОЗИЯ АВТОМОБИЛЯ ВО ВРЕМЯ ЭКСПЛУАТАЦИИ
И ПАССИВНЫЕ МЕТОДЫ БОРЬБЫ С НЕЙ
Особое влияние на коррозию кузова автомобиля
оказывают условия его хранения. Связано это с тем, что автомобиль большую часть
времени содержится на стоянке, в гараже и только небольшую часть времени
находится в движении. Во время движения автомобиль интенсивно обдувается свежим
воздухом, "проветривается", что снижает при прочих равных условиях
скорость коррозии.
Условия хранения в первом приближении можно разделите на хранение автомобиля на
открытой стоянке (в том числе под тентом) и хранение автомобиля в гараже.
Рассмотрим варианты хранения.
КОРРОЗИЯ АВТОМОБИЛЯ НА ОТКРЫТОЙ СТОЯНКЕ
На открытой стоянке на автомобиль постоянно
воздействуют находящаяся в воздухе влага и атмосферные осадки. В условиях
низкой и средней влажности в теплое время года при изменении температуры
воздуха (например, вечером или ранним утром) атмосферная влага конденсируется
по всей поверхности автомобиля как снаружи, так и внутри салона. Наибольшее ее
скопление наблюдается в скрытых полостях (порогах, лонжеронах, стойках, на
внутренней поверхности дверей, потолка под декоративной обивкой) С повышением
температуры влага с открытых поверхностей испаряется но еще продолжительное
время находится в скрытых полостях. В результате именно эти, как правило,
труднодоступные части кузова более других страдают от коррозии. При высокой
влажности воздуха или во время выпадения осадков влага более или менее
равномерно распределяется по всей внешней поверхности автомобиля и поскольку
она в данном случае не застаивается, в наименьшей степени вызывает процесс
коррозии. Однако следует заметить, что и в данном случае возможно накопление
влаги в салоне автомобиля. Таким образом, при хранении автомобиля на открытой
стоянке в максимальной степени подвержены коррозии внутренние поверхности его
кузова. Внешние поверхности корродируют лишь там, где нарушено лакокрасочное
покрытие.
Как это не покажется странным дополнительные меры предосторожности необходимо
принимать при хранении автомобиля под тентом. Тент (например, из брезента)
надежно предохраняет автомобиль от пыли грязи снега и частично от воды, но
совершенно не предохраняет от воздействия на корпус влаги воздуха. Более того,
под тентом влага конденсируется и долгое время находится на кузове автомобиля.
Таким образом, автомобиль под тентом находится как бы в водяной бане, что
способствует коррозии автомобиля в летний период когда после ночной прохлады
температура воздуха повышается. Механизм возникновения ржавчины в этом случае
понятен из предыдущего изложения. Корпус автомобиля и влажный воздух вместе
образуют гальваническую пару, в которой корпус автомобиля является анодом. Если
чехол касается поверхности автомобиля, то от коррозии не спасает даже
лакокрасочное покрытие и ржавчина проступает сквозь краску. Обычно достаточно
нескольких летних утренних туманов чтобы новый автомобиль превратился в груду
ржавого металла. Поэтому, если вы закрываете автомобиль тентом, обязательно
придерживайтесь правил:
1. не допускайте соприкосновения чехла с корпусом
автомобиля;
2. обеспечьте вентиляцию воздуха под чехлом;
3. периодически, особенно в период большой влажности и
перепада температур, снимайте чехол и проветривайте автомобиль.
Реализовать эти правила на практике можно
различными способами.
Из дюралевых уголков размером 40х40 мм изготавливается рама в виде лестницы.
Длина рамы соответствует длине автомобиля, ширина рамы несколько больше ширины
автомобиля. Средние поперечины рамы закрепляются на верхнем багажнике автомобиля
с помощью винтов или веревок. На полученную раму набрасывается брезент
прямоугольной формы. Такая конструкция защищает автомобиль от дождя и грязи,
обеспечивает хорошую вентиляцию (поскольку передняя и задняя стенки
отсутствуют) и в течение нескольких минут разбирается и собирается.
КОРРОЗИЯ АВТОМОБИЛЯ ПРИ ХРАНЕНИИ В ГАРАЖЕ
На первый взгляд, наилучшие условия для
длительного хранения автомобиля создаются в гараже, поскольку гараж
предохраняет автомобиль от внешних осадков. Однако многочисленные исследования
показали, что это справедливо только при малой влажности воздуха. В условиях
большой влажности (в средней полосе этот период включает в себя осень и
особенно весну, т е. почти полгода) скорость коррозии металла в обычном
стальном боксе с бетонным полом составляет 1 мм/год, что в 5—20 раз выше
скорости на открытом воздухе. Причина этого, парадоксального на первый взгляд,
явления состоит в том, что металлические стенки гаража являются примером дополнительного
катода, который и увеличивает скорость коррозии. Наличие столь большого по
размерам дополнительного катода вызывает коррозию как изнутри, так и снаружи
всего корпуса. При этом в большей степени страдают те части кузова, которые
находятся в более влажных нижних слоях атмосферы пол, днище, диски колес,
трансмиссия.
С целью лучшей сохранности автомобиля стенки гаража должны быть окрашены, а пол
необходимо надежно защитить от подземных вод. С этой целью перед укладкой
бетона, асфальта или щебня положите на землю полиэтиленовые листы, которые
полностью закроют поверхность пола Тем самым вы надежно предохраните свой гараж
от влаги, содержащейся в земле, что особенно важно в период осенних дождей и
весеннего половодья. Некоторые автолюбители обивают стены и пол гаража деревом.
Такая защита автомобиля, однако, резко снижает пожаробезопасность. Поэтому,
если имеется такая возможность, лучше для этой цели использовать асбестовое
покрытие или стекловолокно. При обустройстве гаража обязательно предусмотрите
его вентиляцию. Вентиляция гаража способствует постоянному воздухообмену,
снижает влажность воздуха и тем самым замедляет скорость коррозии. Простейший
способ обеспечить вентиляцию гаража состоит в использовании асбестовой трубы
установленной вертикально на высоте 30—40 см над уровнем пола и возвышающейся
на
Диаметр трубы для стандартного гаража объемом 50—60 м3 должен
составлять не менее
КОРРОЗИЯ ДВИЖУЩЕГОСЯ
АВТОМОБИЛЯ
Как правило, при движении скорость коррозии
корпуса автомобиля снижается. Причина этого явления состоит в том, что
встречный воздух интенсивно обдувает корпус автомобиля я, как следствие
снижается влажность воздуха как снаружи, так и изнутри корпуса. Однако при
движении по грязной или мокрой дороге воздействие на корпус автомобиля дождя,
снега, соли, которой посыпают дороги в зимний период, в совокупности с
механическими воздействиями песка мелких камней, льдинок я вибрации приводит к
старению и разрушению покрытия. Наиболее уязвимыми местами при этом являются
внутренние поверхности передних я задних крыльев, днища, трансмиссии и подвеска
автомобиля. Механические воздействия в сочетании с влагой приводят к тому, что
именно эти места корпуса автомобиля начинают корродировать в первую очередь.
Наиболее известные способы защиты корпуса движущегося автомобиля —
противокоррозионная обработка днища и использование подкрыльников. Лучшее
защитное покрытие для днища — это покрытие на основе каучуковых смол, которое
имеет отличную адгезию к металлу и образует толстый, рыхлый слой, в котором
механические частицы (песок, грязь) вязнут, не доходят до металла.
Подкрыльники отлично защищают внутренние поверхности крыльев от механического
воздействия грязи и песка. Вместе с тем между подкрыльниками и защищаемой ими
поверхностью образуется замкнутое пространство, что способствует накоплению
влаги. Поэтому при установке подкрыльников необходимо обеспечить свободный
доступ воздуха для вентиляции и целесообразно снимать подкрыльники на время
длительной стоянки автомобиля.
Приведенные факты, а также собственные наблюдения автолюбителей указывают на
большое разнообразие условий, при которых возникает коррозия корпуса
автомобиля. Среди этого многообразия выделим два условия, которые, на наш
взгляд оказывают наибольшее воздействие образование локальных мест скопления
влаги и конденсирование влаги по всей как внутренней, так и внешней поверхности
кузова автомобиля. Именно для этих случаев и будут рассмотрены методы катодной
защиты.
ПРОТЕКТОРНАЯ ЗАЩИТА ОТ
КОРРОЗИИ
Из описанного ранее механизма коррозии
следует, что если два металла поместить в раствор электролита (простую или
подсоленную воду), то один из них, а именно более активный, начнет испускать
электроны и присоединять к образовавшимся ионам гидроксильные группы (ОН) из
раствора электролита, а другой, менее активный, будет принимать электроны,
присоединяя их к своим ионам. В результате более активный металл — анод — будет
окисляться, а менее активный металл — катод — восстанавливаться. Таким образом,
анод будет защищать катод от коррозии. В обычных условиях анодом является
корпус автомобиля, и именно он прежде всего страдает от коррозии. Для защиты
корпуса автомобиля необходимо обеспечить его контакт с более активным металлом.
По отношению к железу более активными металлами являются кадмий, хром, цинк,
магний и другие металлы. Относительно алюминия необходимо отметить, что
приведенный потенциал соответствует чистому алюминию без оксидной пленки,
которой он покрывается в обычных условиях достаточно быстро. Вместе с тем тот
металл, который в обиходе называется алюминием, также пригоден для защиты
железа и низколегированных сталей. На практике наибольшее применение для защиты
корпуса автомобиля нашли цинк и сплавы магния. Металл, который используется в
качестве анода для защиты, называется протектором, отсюда и название данного
метода.
Для реализации протекторной защиты необходимо протектор плотно закрепить на
чистой поверхности защищаемого металла. Если на эту конструкцию будет
воздействовать влага, то в соответствии с приведенной выше химической реакцией
электроны протектора будут переходить в защищаемый металл и на катоде (корпусе
автомобиля) начнется выделение водорода. Ионы протектора, соединяясь с
кислородом (гидроксильными группами ОН), вызывают окислительную реакцию,
которая приводит к появлению гидроокиси того металла, из которого сделан
протектор Таким образом обеспечивается катодная защита корпуса автомобиля до
тех пор, пока протектор полностью не разрушится вследствие коррозии. После
этого, как и положено, начнет корродировать корпус автомобиля.
Необходимо отметить, что данный метод защиты корпуса автомобиля уже
используется как в отечественной, так и в зарубежной практике. В частности те
части кузова, которые подвергаются наибольшему воздействию влаги
изготавливаются из стали с одно или двусторонним цинковым покрытием толщиной
около 
Для самостоятельной реализации протекторной защиты необходимо, прежде всего,
иметь несколько пластин протектора — цинка или сплава магния. Площадь каждой
пластины должна составлять несколько десятков квадратных сантиметров, толщина -
не менее
Необходимо отметить, что протекторная защита находит широкое применение для
защиты таких объектов, как подземные трубопроводы. резервуары, морские и речные
суда Все эти объекты находятся в постоянном контакте с электролитом, будь то
грунтовые воды, химические растворы, морская или речная вода. При этом
электролит охватывает всю защищаемую поверхность. В этих условиях допускается
локальное размещение протектора на защищаемой поверхности.
Легковые автомобили, как это было показано ранее, эксплуатируются в существенно
иных условиях. Поэтому протекторная защита носит в этом случае локальный
характер и защищает только те места, которые находятся в непосредственной
близости к протектору. Кроме того, для использования этого метода защиты
необходимо иметь дефицитный металл для протектора. Более эффективным методом, с
этой точки зрения, является метод электрохимической защиты.
ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА ОТ КОРРОЗИИ
Из изложенного выше следует, что потенциал
защищаемого металла может быть изменен, если использовать внешний источник
напряжения, что и составляет основу электрохимического метода защиты
(электрозащиты). Для того чтобы наглядно увидеть действие электрозащиты,
целесообразно провести следующий простой эксперимент.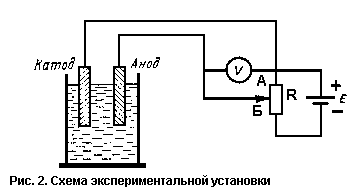
В стакан или небольшую стеклянную банку с раствором электролита поместите две
небольшие стальные пластины. К пластинам подсоедините с помощью пайки или
каким-либо иным способом провода и соберите схему (рис. 2). Переменный резистор
должен иметь сопротивление порядка 500—1000 Ом. В качестве источника напряжения
12В можно использовать аккумуляторную батарею, автомобильное зарядное
устройство или набор батареек. После того как все соединения выполнены, можно
приступать к эксперименту. Левый по схеме электрод будет катодом, правый —
анодом.
С помощью переменного резистора R можно изменять разность потенциалов между
электродами, изменяя тем самым скорость коррозии защищаемого металла (катода).
Разность потенциалов определяется с помощью вольтметра V.
При нахождении ползунка резистора в точке А разность потенциалов между
электродами равна нулю, и оба металла корродируют с одинаковой скоростью.
Процесс коррозии характеризуется довольно низкой скоростью и, вообще говоря,
необходимо несколько дней, чтобы увидеть явные признаки ржавчины на металле.
Если передвигать ползунок резистора от точки А к точке Б, то разность
потенциалов будет увеличиваться. При положительных показаниях вольтметра
образуется защитный потенциал, который полностью остановит процесс коррозии
катода. При этом можно будет наглядно наблюдать выделение водорода на катоде и
процесс образования ржавчины на аноде В данном случае анод, имеющий
положительный потенциал, будет притягивать к себе гидроксильные группы (ОН) из
раствора электролита и окислиться, а избыточные электроны под действием
внешнего источника напряжения будут переходить на катод и восстанавливать его.
Для увеличения скорости реакции достаточно растворить в банке с водой половину
чайной ложки поваренной соли.
Теоретически для полного прекращения коррозии необходимо обеспечить защитный
потенциал, равный стандартному электродному потенциалу защищаемого металла,
который для железа равен 0,44В. В действительности же различные включения в
железо вызывают продолжение процесса коррозии. Для предотвращения этого явления
необходимо дополнительно увеличить разность потенциалов между анодом и катодом.
Какова же максимально допустимая величина этого напряжения.
Обращаясь вновь к экспериментальной установке, можно видеть, что с увеличением
разности потенциалов резко возрастает интенсивность выделения водорода на
катоде. Происходит это потому, что одновременно с увеличением разности
потенциалов возрастает и ток между электродами, который и приводит к
наблюдаемому эффекту. Многочисленные исследования показали, что сила тока между
электродами зависит от состояния защищаемой поверхности, в том числе от наличия
защитного лакокрасочного покрытия и может изменяться от 0,05 мА (при хорошем
состояние металла) до 10 мА (при нарушенном лакокрасочного покрытии) на каждый
квадратный метр защищаемой поверхности. При этом максимальный защитный
потенциал должен быть порядка 1В.
УСТРОЙСТВО ДЛЯ ЭЛЕКТРОХИМИЧЕСКОЙ ЗАЩИТЫ КУЗОВА
АВТОМОБИЛЯ ОТ КОРРОЗИИ
Принцип действия устройства основан на создании
гальванической пары между кузовом автомобиля и дополнительными электродами.
Описываемое устройство легко может сделать каждый автолюбитель из недефицитных
деталей. Это устройство аналогично тем изделиям (антикорам), которые в
настоящее время имеются в продаже, однако стоимость его в несколько раз ниже.
Основное отличие предлагаемого устройства от промышленных состоит в том, что с
целью упрощения в нем отсутствуют элементы, сигнализирующие о работоспособности
устройства. Однако высокая надежность устройства и соблюдение простейших
условий эксплуатации делают эти элементы излишними.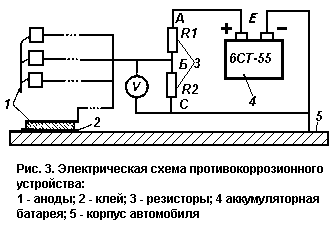
Электрическая схема простейшего устройства приведена на рис. 3.
Устройство содержит делитель напряжения, выполненный на двух резисторах
сопротивлением R1 и R2 соответственно. Верхний по схеме вывод резистора R1
соединен с положительным выводом аккумулятора, нижний по схеме вывод резистора
R2 соединен с отрицательным выводом. При таком соединении резисторов в точке Б
относительно метала кузова автомобиля будет потенциал V1 который
определяется из выражения
U = Е
х R2/(R1 + R2)
где Е — напряжение аккумулятора 12 В.
Потенциал U должен быть равен защитному потенциалу, при котором прекращается
процесс коррозии.
При последовательном соединении резисторов через них течет ток, равный
I =
E/(R1 + R2)
Сила тока (01-100 мА) выбирается из условия,
что при обычной влажности один анод надежно защищает примерно 4-10 дм2 площади.
R2 =
V/I; R1 = (E/I) - R2
Если по каким-либо причинам необходимо
изменить значения защитного потенциала или силу тока, соответствующие значения
сопротивлений резисторов могут быть определены из приведенных соотношений.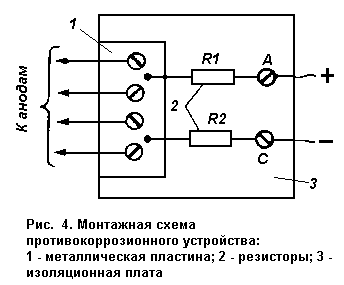
К точке 1 делителя необходимо припаять длинные провода (в изоляции), к другим
концам которых припаять стальные пластины—аноды. Каждый анод представляет собой
пластину из низкоуглеродистой стали прямоугольной формы размерами примерно 2х2
см. Для защиты можно использовать и внешние аноды, о чем будет сказано далее.
Предлагаемое устройство превращает корпус автомобиля в катод, который в
процессе эксплуатации будет восстанавливаться за счет окисления анодов.
Конструкция устройства — произвольная. В простейшем случае делитель можно
расположить на небольшой изоляционной пластине (гетинакс, пластмасса), верхний
вывод резистора R1 и нижний резистора R3 закрепить на этой пластине с помощью
винтов, а остальные выводы припаять к металлической пластине, к которой провода
от анодов могут также закрепляться с помощью винтов (рис. 4).
Все устройство необходимо поместить в какую-либо изоляционную коробочку или
залить эпоксидной смолой. Устройство удобно разместить в моторном отсеке
автомобиля вблизи аккумулятора.
Противокоррозионные устройства, поступающие в продажу, имеют определенные
средства контроля — светодиоды, сигнализирующие о включении устройства и о
пропадании потенциала в точке К. Подобное контрольное устройство (например,
триггер Шмидта) можно добавить и предлагаемое устройство. Однако проще 1 раз в
месяц замерить потенциал на выходе устройства в точке Б и убедиться а его
работоспособности, тем более что визуальный контроль все равно необходим. Кроме
того, введение контрольных элементов увеличивает потребляемую силу тока с 1 до
10 мА, ограничивает тот период времени, в течение которого можно не подзаряжать
аккумулятор. Это время можно оценить по следующей методике.
Из руководства по эксплуатации автомобиля, да и из собственной практики
автомобилист знает, что устойчивый пуск двигателя с помощью стартера возможен,
если емкость аккумулятора составляет не менее 60% номинальной.
Если использовать готовое устройство с током потребления 5 мА, то время, в
течение которого аккумулятор можно не подзаряжать (Т) составляет 40 дней. С
учетом саморазряда аккумулятора это время будет еще меньше. Предлагаемое же
устройство фактически не разряжает аккумулятор (время Т при его использовании
может составлять более года) что особенно важно при длительном хранении
автомобиля.
ПРАВИЛА УСТАНОВКИ И ЭКСПЛУАТАЦИИ УСТРОЙСТВА
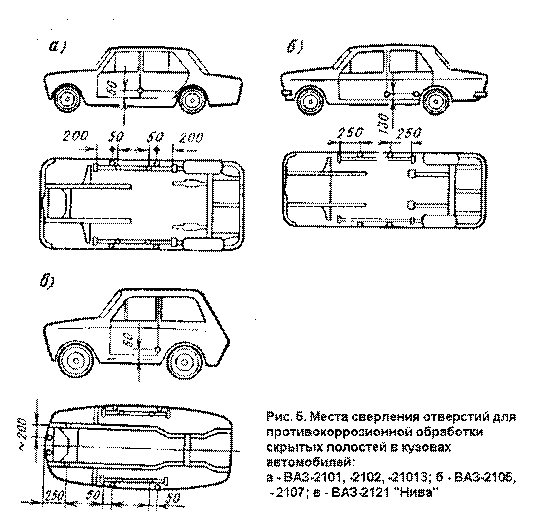
Для защиты кузовов используются аноды в виде
небольших металлических пластин, припаянных к концам длинных проводов, вторые
концы которых закреплены в точке Б (см. рис. 4) устройства. Каждую пластину, в
свою очередь, необходимо с помощью клея (эпоксидная смола) приклеить к заранее
выбранным и очищенным от грязи местам кузова автомобиля, наиболее подверженным
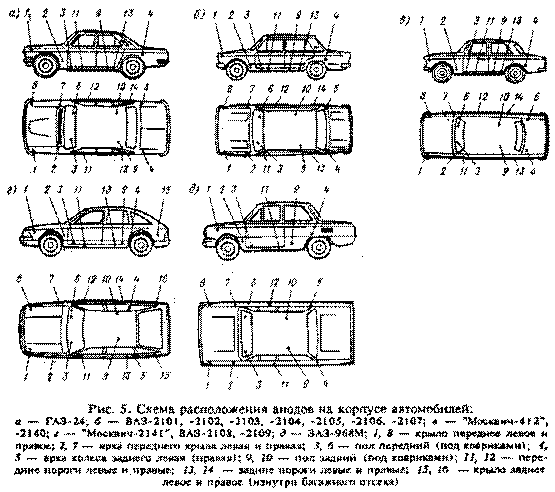
коррозии (рис.5).
Такими местами являются:
- внутренние части передних и задних крыльев;
- передние и задние пороги;
- пол в салоне под ногами водителя и пассажиров;
- внутренняя поверхность крышки багажника и капота двигателя;
- задние стенки багажного отделения автомобилей с кузовом типа
Хэтчбек (АЗЛК 2141, ВАЗ-2108, ВАЗ-2109 и др);
- потолок салона, внутренние поверхности дверей.
Таким образом, всего необходимо изготовить
16-20 анодов. Если уменьшить или увеличить число защищаемых мест, то
соответственно изменится и общее количество анодов.
Выбор мест установки анодов необходимо сделать с учетом схем расположения
скрытых полостей кузова автомобиля (см. прил. рис 1—4).
При установке анодов особенно внимательно необходимо следить за тем, чтобы не
допустить короткого замыкания анодов на корпус. Для проверки правильности
монтажа необходимо при отключенном от аккумулятора устройстве замерить с
помощью омметра сопротивление между точкой Б и корпусом автомобиля. Это
сопротивление должно быть равно сопротивлению R2, т.е. порядка 2 к0м. Если
прибор покажет нулевое сопротивление, то один или несколько анодов замкнуты на
корпус и необходимо устранить эту неисправность. В случае отсутствия омметра
достаточно подать на устройство питание и замерить потенциал в точке Б
относительно корпуса который должен быть равен приблизительно 2 В. После
монтажа всех анодов и прокладки проводов к устройству можно подавать напряжение
и защита начнет действовать.
Читатель наверняка уже понял, что по своему эффекту электрохимическая защита в
данном случае соответствует протекторной защите. При этом роль протектора
выполняют аноды, на которые подан положительный потенциал. Поэтому все
достоинства и недостатки протекторного метода, о которых было рассказано ранее,
переносятся и на этот метод. В частности необходимо помнить, что вследствие
ограниченного размера анода в наибольшей степени защита будет действовать в
ограниченной околоанодной области (локальная защита). При высокой влажности
воздуха условия для защиты всего кузова автомобиля улучшаются, поскольку в этом
случае влага более или менее равномерно распределяется по всей поверхности
автомобиля.
Рассмотрим теперь важный вопрос о влиянии отказов устройства на его способность
защищать кузов от коррозии. Мы выделим два вида отказов короткое замыкание
анода на корпус и обрыв провода от устройства к аноду (или, что тоже, снятие
напряжения с устройства).
Отказы устройства приводят к тому, что корпус автомобиля и дополнительные
электроды образуют гальванический элемент, в котором роль анода и катода будут
выполнять металлы в соответствии с их стандартным потенциалом. При этом, если,
материал, из которого сделан электрод, активнее материала корпуса автомобиля то
электрод будет являться в этом случае протектором и защитит корпус автомобиля.
Если же материал электрода менее активен, то в полученной гальванической паре
он будет вызывать коррозию уже самого кузова автомобиля. Поэтому материал
электрода должен в максимальной степени соответствовать материалу кузова автомобиля.
В этом случае негативные последствия отказа устройства сведутся к минимуму.
Основное условие правильной эксплуатации устройства состоит в регулярной
проверке наличия потенциала в точке Б и проверке целостности проводов
обустройства к анодам.
Таким образом, локальная защита позволяет в условиях малой и средней влажности
полностью предотвратить коррозию тех частей кузова, которые находятся в
непосредственной близости к анодам. Этот метод высокоэффективен также при
высокой влажности воздуха, когда влага равномерно распределяется по всей
поверхности кузова. Вместе с тем локальный метод обеспечивает защиту только
внутренних поверхностей кузова, трудоемок при установке большого числа анодов и
требует периодического контроля за состоянием анодов и подходящих к ним
проводов.
ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА
Из предыдущего изложения читателю уже стало
ясно, что для потной защиты кузова автомобиля необходимо увеличивать площадь
анода. Эту задачу можно решить, если в качестве анода использовать поверхность
земли во время стоянки автомобиля, металлические сетки гаража или какую-либо
другую металлическую арматуру (например, забор). Во всех этих случаях для
защиты кузова используется внешний анод.
Выше уже отмечалось, что поверхность земли является проводником сопротивление,
которого резко уменьшается в условиях большой влажности, т.е. именно тогда
когда процессы коррозии
идут наиболее интенсивно. В этих условиях поверхность земли можно использовать
в качестве анода, если сообщить ей положительный относительно кузова автомобиля
потенциал. Эту задачу можно решить по-разному, ниже приводится несколько
практических рекомендаций.
Проведите провода от точки Б устройства к брызговику переднего колеса.
Оголенный конец провода с помощью винта закрепите на брызговике. На этом же
винте закрепите металлическую цепь, которая должна касаться земли (по типу
того, как заземляются кузова бензовозов). Длина цепи выбирается из условия,
чтобы она не попадала под колесо при движении автомобиля назад.
Таким образом, при движении автомобиля или во время его стоянки защитный
потенциал от устройства будет передаваться на поверхность земли и сообщать ей
положительный потенциал. В гальванической паре кузов автомобиля — поверхность
земли кузов автомобиля будет катодом, а поверхность земли — анодом, что надежно
защитит днище и внешнюю поверхность автомобиля от коррозии.
Во время открытой длительной стоянки автомобиля можно еще более повысить
эффективность защиты. Для этого вкопайте в землю рядом с автомобилем
металлический штырь, который соедините с помощью провода с выходом вашего
устройства. С этой же целью можно использовать металлический зa6op, ограду или
подложить на землю под автомобиль подходящего размера кусок железа. Особо
необходимо выделить случай защиты автомобиля при его хранении в металлическом
гараже. В настоящее время наряду с обычными стационарными боксами широкой
популярностью пользуются гаражи типа "Ракушка", "Хлебница".
Эти гаражи надежно защищают автомобиль от непосредственного влияния грязи,
дождя, снега, механических повреждений, но вместе с тем увеличивают скорость
коррозии кузова. Причин этого явления несколько — малый объем гаража, плохая
вентиляция, отсутствие пола. Все эти факторы приводят к появлению внутри гаража
"парникового эффекта" — повышенной температуры и влажности, которые в
сочетании с близко расположенными металлическими стенами гаража и кузова
образуют гальваническую пару — основную причину коррозии. Надежной и почти
единственной защитой в этом случае является использование электрохимического
метода. При этом, однако, большое значение имеет выбор оптимальных значений
защитного потенциала и силы тока, при которых обеспечивается снижение скорости
коррозии, отсутствует выделение водорода и, кроме того, возможно частичное
восстановление поврежденного металла.
Эта задача решена предприятием "Грань", выпускающим устройство БОР-1
для защиты от коррозии, автоматически поддерживающее оптимальные значения
защитного тока и напряжения. (При разработке устройства учтены а.с. 198883,
163741)
Это устройство продается совместно с гаражами фирмы "СПМ" г. Москва,
но может эксплуатироваться с гаражами других типов, в том числе и со
стационарными.
Само устройство выполнено в виде штекера под стандартный разъем автомобильного
прикуривателя или переносной лампы, что позволяет быстро и надежно подключать
его к автомобилю, не требует подзарядки аккумулятора (без учета саморазряда)
при длительном (до двух лет) хранении автомобиля, а эффект от его использования
проявляется уже в первые месяцы эксплуатации.
Использование внешнего анода по сравнению с локальной защитой существенно менее
трудоемко, поскольку отпадает необходимость в установке большого числа
электродов, и более эффективно, поскольку защищается как внешняя, так и
внутренняя поверхность кузова, особенно при хранении автомобиля в гараже.
Некоторое неудобство вызывает необходимость "привязывать" автомобиль
на время стоянки, однако высокая степень защищенности автомобиля сторицей
вознаградит за эти дополнительные хлопоты.
В реальной жизни, очевидно, лучше использовать комбинацию рассмотренных методов
защиты. При этом достаточно использовать 4 – 6 анодов, которые необходимо
установить в наиболее уязвимых с вашей точки зрения местах (см. рис. 5), и
дополнительно использовать внешний анод одним из указанных выше способов.
ЗАЩИТА ПОВРЕЖДЕННЫХ В РЕЗУЛЬТАТЕ АВАРИИ ЧАСТЕЙ КУЗОВА
В процессе эксплуатации автомобиля, к
сожалению, неизбежны механические повреждения частей кузова в результате
наездов, столкновений и т.д. Хорошо известно, что после механических
повреждений металл в поврежденных местах быстро ржавеет, причем от этого
явления лакокрасочное покрытие уже не спасает. Одной из основных причин
коррозии в данном случае является появление внутренних местных механических
напряжений, разрушающих структуру металла.
Практически единственным методом защиты от коррозии металла с внутренними
напряжениями является катодная защита, поскольку она предотвращает воздействие
внешних факторов на металл.
Использование катодной защиты и в частности электрохимической защиты в данном
случае облегчается тем, что требуется локальная защита металла. Для защиты
кузова закрепите, как это было описано ранее, протектор (если используете
протекторную защиту или аноды, если используете электрозащиту) на тех местах
кузова, которые подверглись наибольшей деформации. Катодная защита и в данном
случае не только полностью предотвратит коррозию, но и в определенной степени
частично восстановит уже начавший ржаветь металл. После установки катодной
защиты на металл можно нанести лакокрасочное покрытие, которое дополнительно
защитит кузов вашего автомобиля и обеспечит его долгую жизнь.
Прочитав эту книгу, читатель может достаточно
быстро, в течения дня собрать и установить на автомобиль описанное
противокоррозионное устройство. Но вот проходит день, два, неделя, а ржавчина
все на месте. Невольно начнут закрадываться сомнения в работоспособности
устройства и вообще в правильности всего метода защиты — ведь ожидаемого и
обещанного эффекта нет.
В этой связи необходимо предупредить автолюбителей о том, что процессы коррозии
являются достаточно медленными процессами, которые на глаз не заметны. Защита
начинает действовать сразу же после установки, но практически эффект может быть
заметен только после нескольких лет эксплуатации автомобиля. По прошествии
этого времени вы с удивлением обнаружите, что металл после снятия с него
обычной грязи совершенно чист и не содержит даже следов коррозии. То же самое
относится и к скорости восстановления металла. По сути дела, если автомобиль
эксплуатировался несколько лет, в течение которых на его кузове появились следы
коррозии, то необходим, по крайней мере, такой же промежуток времени, чтобы
восстановить испорченный металл. В основном все здесь определится тем,
насколько внимательно вы изучили особенности кузова своего автомобиля и правильно
расположили аноды (протекторы) защитного устройства.
Тем не менее, позволю здесь одно частное наблюдение. Свой автомобиль в зимний
период я храню в обычном металлическом гараже. Осенне-весенний период в Москве
в последние годы был очень влажным и автомобиль начал сильно ржаветь. Другого
ничего не оставалось, как установить противокоррозионное устройство предприятия
"Грань". При этом стенки гаража выполняли роль внешнего анода. Прошло
две недели. Придя в очередной раз в гараж, я был поражен внешним видом
автомобиля; ржавчина, которая ранее образовалась на двигателе, внутренней
поверхности крышки капота, на дисках колес, буквально отваливалась от металла.
Достаточно было легкой протирки, чтобы проявился абсолютно чистый металл.
Конечно, здесь описан результат только единичного наблюдения, но и он говорит о
высокой эффективности предлагаемого метода защиты от коррозии.
СКРЫТЫЕ
ПОЛОСТИ КУЗОВОВ АВТОМОБИЛЕЙ
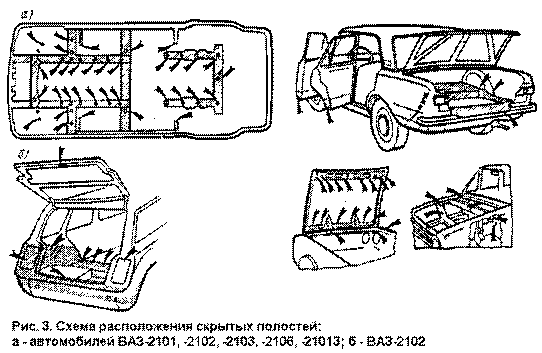
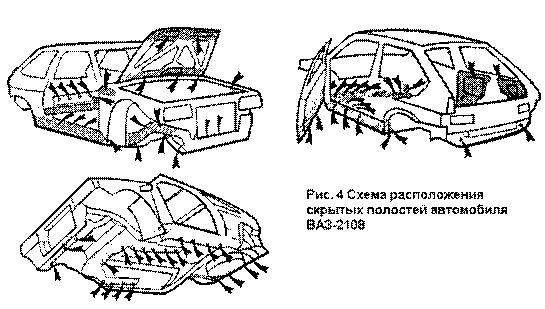
Наиболее уязвимыми для коррозии частями
кузова автомобиля являются скрытые полости и щели (пороги внутренние балки,
лонжероны стоики поверхности дверей потолок — рис, 1—4)
Места сверления отверстий для дополнительной защиты скрытых полостей автомобиля
противокоррозионными покрытиями показаны на рис. 5.
При использовании катодной защиты дополнительная противокоррозионная обработка
не требуется, однако окончательное решение остается за автолюбителем.


ПРИЛОЖЕНИЕ 2.
ИСПОЛЬЗОВАНИЕ ЗАЩИТНЫХ ПОКРЫТИЙ ДЛЯ ПРЕДОТВРАЩЕНИЯ КОРРОЗИИ КУЗОВА АВТОМОБИЛЯ
Эффективность защиты кузова автомобиля от
коррозии с помощью покрытий, в основном, определяется тремя составляющими,
выбором типа покрытия отвечающего условиям эксплуатации автомобиля качеством
подготовки поверхности перед нанесением на него покрытия и степенью
соответствия технологии нанесения покрытия техническим условиям для данного
покрытия.
Выбор типа защитного материала. Для повышения эффективности противокоррозионной
обработки кузова применяют защитные материалы, в состав которых вводят
специальные добавки - ингибиторы коррозии, снижающие вероятность возникновения
коррозионных процессов или уменьшающие их скорость. К подобным материалам
относятся пленкообразующие ингибиторные нефтяные составы (ПИНС) Наличие в их
составе растворителей, специально подобранных загустителей и значительного количества
маслорастворимых ингибиторов коррозии обеспечивает им по сравнению с
традиционными защитными материалами следующие основные преимущества:
- легкость нанесения пульверизацией, погружением, кистью;
- высокие защитные свойства в тонкой пленке;
- проникновение в микрозазоры, микротрещины;
Каждое покрытие используется для защиты
вполне определенной части кузова автомобиля днища автомобиля узлов шасси
скрытых поверхностей лакокрасочных покрытий.
Для защиты днища автомобиля используются защитные мастики предохраняющие днище
и крылья автомобиля от ударов песка, гравия а также изолирующие их от
воздействия агрессивных факторов К подобным мастикам относятся мастики № 579,
580, 4010, мастика БПМ-1 паста автомобильная ПА и другие.
Для защиты шасси и днища кузова используются специально разработанные составы
НГ-216. НГ-222 и НГМ-шасси.
Принципиальным отличием ПИНСов от смазок является то, что они защищают металл
от коррозии при толщинах пленок 50—100 мкм с такими же гарантийными сроками,
как и смазки при толщине слоя до
Испытания защитных средств показали что наилучшие результаты достигаются при
использовании ПИНСов НГМ шасси двухслойного покрытия из мастики БПМ-1 и ПИНСа
НГ-216 либо БПМ-1 и НГ-шасси. Эти продукты по абразивоустойчивости и защитным свойствам
не только не уступают материалу Тектил-122А, производимому шведским филиалом
фирмы "Вальволин Оил" (США), но и превосходит его и может успешно
применяться для противокоррозионной обработки днища автомобилей.
Для защиты скрытых поверхностей кузова эффективны составы НГМ-МЛ, Мовиль,
Мольвин. Защитное действие состава НГМ-МЛ заключается в вытеснении электролита
с поверхности металла, образовании необратимо абсорбированной пленки ингибитора
коррозии на металле, формировании пленки, способствующей анодной поляризации
металла. Проникая в микрозазоры и трещины, состав защищает от коррозии не
только чистый металл, но и металл, покрытый неингибированными мастиками и
эмалями.
Коррозионными испытаниями установлено, что новые консервационные материалы
НГМ-МЛ и Мольвин обладают высоким уровнем защитных свойств и по этому
показателю не уступают зарубежному продукту Тектил-309АЖ-20 и значительно
превосходит его по термостойкости.
Защита лакокрасочных покрытий эффективно осуществляется с помощью
водоэмульсионных и восковых ПИНСов. Ассортимент этих продуктов включает в себя
ЛБХ ("Автоконсервант"), ПЭВ-74, ПСС-6, а также зарубежные защитные
средства АЭРО-6, Экспротект, Шпрювакс и др. Отличные защитные свойства имеет
консервационная смазка ПВК..
Подготовка поверхности перед нанесением покрытия. Подготовка поверхности
преследует две основные цели удаление остаточных продуктов коррозии и
обеспечение высокой адгезии защитного материала с металлом. Нелишне напомнить,
что поверхность металла должна быть абсолютно сухой.
Высокие требования к чистоте поверхности металла определяются, прежде всего,
стремлением предотвратить коррозионный процесс под слоем защитного покрытия
Механизм этого процесса в основном соответствует механизму, приведенному в
основной части книги, однако имеет свои особенности.
В процессе эксплуатации автомобиля на поверхности защитного покрытия образуются
трещины являющиеся основными очагами коррозии. Трещины в покрытиях позволяют
воде и растворенному кислороду контактировать с незащищенной сталью. Более
высокое содержание кислорода в верхней части открывшейся области стали по
сравнению с содержанием кислорода на краю поверхности соприкосновения металла с
покрытием приводит к тому, что область контакта металла с покрытием становится
анодной и подвергается коррозии. В этих областях первоначально образовавшиеся
продукты коррозии переходят в конечное низкоэнергетическое стабильное состояние
в виде окиси железа.
С целью предотвращения этого явления кроме чисто механических средств (мойка,
зачистка) используются специальные материалы растворители преобразователи
ржавчины, обезжиривающие и фосфатирующие составы, грунтовки и шпатлевки.
Технология нанесения защитного покрытия. Эффективность защиты кузова автомобиля
от коррозии во многом определяется технологией нанесения покрытия на
поверхность металла, которая, как правило, описана в руководстве по применению
соответствующего состава. Важным здесь является то что высокий защитный эффект
большинства покрытий достигается за счет наложения друг на друга нескольких
слоев с обязательной просушкой каждого слоя. Необходимость придерживаться такой
технологии вызвана тем, что в соответствии с современными представлениями на
механизм защитного действия консервационные материалы на поверхности металла
образуют несколько слоев различной прочности. Слой, непосредственно прилегающие
к металлу могут удерживаться на поверхности чисто физическими силами адсорбции.
Вся пленка защитного материала удерживается на металле силами адгезии
(прилипания) а прочность пленки, ее проницаемость обуславливается энергией
связи молекул и частиц защитного материала между собой.
Защитный эффект консервационного материала определяется двумя составляющими —
изоляционной предохраняющей металл от воздействия влаги, и поляризационной
тормозящей развитие электрохимических процессов коррозии. Поэтому многослойное
наложение покрытия позволяет создать необходимые условия для эффективной защиты
металла.
ЕЩЁ …(слово из трёх букв, которого боится
каждый мужчина)
Многим автолюбителям известно, что достаточно появиться
небольшой царапине - и ржавчина начинает прямо-таки поглощать автомобиль. И
бороться с ней весьма трудно. Какие только хитрости ни придумывают
автомобилисты - различные покрытия, мастики, антикоры... Да вот беда: чтобы
обработать с должным качеством все наиболее поражаемые места, приходится порой
разбирать весь автомобиль. Такая операция занимает немало времени, да и требует
постоянного контроля. Кроме того, в процессе эксплуатации происходит
постепенное разрушение покрытий. Из-за вибраций при движении появляются
микротрещины, под ударами камней или песка краска откалывается. Поэтому вполне
понятно желание автомобилистов приобрести чудо-прибор: один раз потратился и
навсегда защитил кузов от ржавчины.
Метод
катодной защиты от коррозии уже давно применяется на самых разнообразных
объектах. Например на кораблях устанавливают специальные протекторы, которые,
растворяясь в морской вода, обеспечивают защиту корпуса судна. Подземные
трубопроводы перед укладкой обрабатывают антикоррозийными составами и обматывают
специальной лентой. На определенном расстоянии от трубопровода закапывают анод
(электрод) - металлическую болванку, к которой подключают "плюс"
источника постоянного тока, а к самой трубе - "минус". Благодаря
разности потенциалов между электродом и защищаемым металлом в цепи
образующегося электролита (влага, соль и т.п.) проходит ток. На аноде
происходит освобождение электронов - реакция окисления, и саморастворение
катода прекращается [1, 2].
При катодной
поляризации металлу нужно сообщить такой отрицательный потенциал, при котором
его окисление становится термодинамически маловероятным.Для железа и его
сплавов полная защита от коррозии достигается при потенциале 0,1...0,2 В.
Дальнейший сдвиг потенциала мало влияет на степень защиты. Плотность защитного
тока должна быть в пределах 10...30 мА/м2.
Кроме того,
со временем на металле за счет концентрационной поляризации по кислороду
наблюдается дополнительное смещение потенциала в отрицательную сторону, что
позволяет периодически выключать устройство (при ремонте автомобиля, зарядке
аккумулятора и т.п.)[3].
Устройство
защиты от коррозии состоит из электронного блока и защитных электродов. На
корпусе электронного блока размещают световую индикацию работы устройства.
Устройство
позволяет поддерживать значение потенциала влажных участков поверхности кузова
на уровне,необходимом для полной остановки и прекращения коррозийных процессов
за счет разрушения защитных электродов.
В качестве
защитных электродов (анодов) могут использоваться как разрушающиеся материалы
(нержавеющая сталь, алюминий), требующие замены через 4...5 лет, так и
неразрушающиеся. В качестве неразрушающихся электродов можно применять
карбоксил, магнетит, графит или платину. Защитные электроды выполняются в виде
прямоугольных либо круглых пластин площадью 4...9 см2.
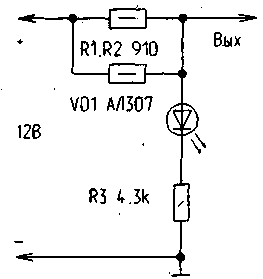
На рисунке
приведена схема простого антикоррозийного устройства, которое может успешно
справляться с явлениями коррозии. Конечно, в простейшем виде устройство
катодной защиты может состоять из защитных электродов и проводов, подключаемых
непосредственно на "плюсовую" клемму аккумулятора. Однако здесь
трудно контролировать возможное короткое замыкание электродов с кузовом
автомобиля и его работу в целом. Для этого в устройстве в цепь делителя
напряжения R1, R2, R3 включен светодиод VD1, который в рабочем режиме светится
ровным светом, потребляя незначительный ток от аккумулятора (около 2 мА).
Если вдруг
один из защитных электродов замыкается на кузов автомобиля, светодиод VD1
прекращает светиться. В этом случае необходимо найти-и устранить замыкание. При
повышенной влажности кузова светодиод VD1 может в небольших пределах изменять
свое свечение, что указывает на работу катодной защиты. Кроме того, данное
устройство имеет высокую надежность, поскольку дает при коротком замыкании выхода
с кузовом ток перегрузки не более 25...30мА.
При
установке и монтаже устройства следует помнить, что:
- один
защитный электрод защищает площадь с радиусом около 0,25...0,35 м;
- защитные электроды устанавливаются только на места, защищенные лакокрасочным
покрытием;
- использовать можно только эпоксидный клей или шпатлевку на его основе;
- наружную сторону защитных электродов (где нет пайки) нельзя покрывать
мастикой, краской, клеем или другим электроизоляционным покрытием.
Электронный
блок устанавливается в любом месте автомобиля и присоединяется к общей схеме
электрооборудования автомобиля. При этом необходимо, чтобы электронный блок
оставался включенным даже при отключенном общем электрооборудовании автомобиля.
В целом
устройство потребляет не больше чем часы автомобиля и гарантирует длительную
эффективную работу даже при сильно разряженном аккумуляторе.
Литература
1.
Красноярский В.В., Зобов Е.В. Электрохимическая защита сооружений и
оборудования от коррозии. -1981.
2. Люблинский Е.Я. Электрохимическая защита от коррозии. -1987.
3. Тершин В., Бондаренко А. Ток защищает от коррозии // За рулем.-1993.-N 12.
-С.23.
П.БЕЛЯЦКИЙ,
633190, Новосибирская обл., г.Бердск-9, а/я 833.
Ещё,ещё… За шаблон
мы возьмём схематичное изображение автомобиля, доработав его простой, но
"толковой" схемой защиты. В схеме имеется три
цепи защиты: Первая
цепь катодной защиты – цепь "стационарной" защиты с использованием
контура заземления, или корпуса металлического гаража (ракушки). Является самым
эффективным способом защиты автомобиля от коррозии в условиях
"парника" металлического гаража. Применяется с дополнительным
проводом, подключаемым одним концом в гнездо Гн1, другим соединяется с
соответствующим анодом. Гнездо Гн1 можно расположить в любом удобном для Вас
месте автомобиля. Удобнее всего – в салоне, у водительского места. В состав
первой "стационарной" цепи защиты входят светодиод VD1, резистор R1,
гнездо Гн1 и многожильный монтажный изолированный провод. Если у Вас нет
условий для использования этого вида защиты, не переживайте, значит у Вас и нет
металлического гаража, а так же есть остальные цепи защиты. Вторая
цепь катодной защиты – цепь "мобильной" защиты с использованием
заземляющего «хвоста». Это наиболее эффективная защита от коррозии во время
дождя, тумана, мокрого дорожного полотна. Электрод-хвост располагается сзади автомобиля,
на одной линии с колесом, для того, чтобы брызги воды от колеса попадали на
хвост. В состав второй "мобильной" цепи защиты входят светодиод VD2,
резистор R2, изолятор (на рисунке - коричневый), заземляющий электрод - хвост
Э1. Дополнительно в состав второй цепи входят элементы R3 и С1, которые
совместно с Э1 выполняют функцию защиты кузова автомобиля от статического
напряжения. Обратите внимание, что хвост прицепляется не непосредственно к
металлическому кузову автомобиля, а через изоляционный материал. В качестве
хвоста используйте тонкую металлизированную резиновую ленту. Как вариант, можно
использовать тонкостенный резиновый шланг с продетым в него тонким
металлическим тросиком, выглядывающим на конце. Третья
цепь катодной защиты – цепь "постоянной" защиты от коррозии с
использованием протекторных пластин. Эта защита от коррозии действует
постоянно, как на стоянке, так и в движении, как во время дождя, так и в сухую
погоду. Её эффективность зависит от количества, размеров и мест расположения
пластин-электродов. Чем суммарная площадь электродов больше, тем лучше. Но
учтите, что электроды должны быть распределены по кузову автомобиля в наиболее
уязвимых для коррозии местах. О самих протекторах было написано выше. Наиболее
приемлемый не дорогой материал для протекторов – нержавеющая сталь. В состав
третьей "постоянной" цепи защиты входят светодиод VD3, резистор R4 и
протекторы (на рисунке - синие). Номиналы
резисторов R1, R2, R4 схемы защиты выбраны такими, чтобы в случае замыкания
протекторов, хвоста, или гаражной конструкции на кузов автомобиля максимальный
ток был ограничен номинальным значением тока светодиодов – 10mA. Другими
словами, в условиях сухого воздуха (сухого кузова автомобиля) светодиоды не
должны гореть. Если в сырую погоду, светодиоды загораются, то это
свидетельствует о работе катодной защиты. Чем больше влажности, тем ярче будут
гореть светодиоды. Если один из светодиодов горит максимально ярко на
"сухом" автомобиле, то это означает, что имеет место неисправность –
замыкание элементов защиты от коррозии на корпус автомобиля. Тогда необходимо,
не позднее чем в течение недели после загорания светодиода определить место
замыкания и устранить его. Основное назначение светодиодов – контроль
исправности цепей катодной защиты. В условиях минимального воздействия влаги
они не должны ярко светиться. Слабое свечение допускается.
Устройство позволяет поддерживать значение потенциала влажных участков
поверхности кузова на уровне, необходимом для полной остановки и прекращения
коррозийных процессов за счет разрушения защитных электродов,
в качестве которых выступают стенки металлического гаража, защитные протекторы.
Кроме того, во время осадков в качестве защитного анода используется и мокрая
поверхность дорожного полотна. 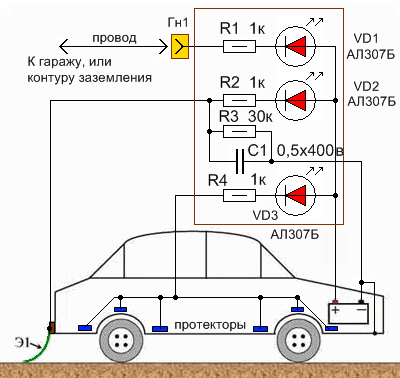
Проверку исправности цепей защиты на обрыв проводят приблизительно 1 раз в
месяц путем замыкания на корпус автомобиля: первую цепь проверяют замыканием
провода, который должен крепиться к стенке металлического гаража; вторую –
замыканием заземляющего хвоста; третью – замыканием одного из протекторов. При
замыкании, соответствующий светодиод должен загореться. Для удобства, можно
использовать дополнительный монтажный провод. Неплохо, при проверке исправности
схемы катодной защиты ещё и осмотреть защитные протекторы.
Само нехитрое устройство можно разместить в любом удобном для Вас месте. Нет
необходимости размещать его на панели приборов, перед глазами водителя. Там оно
будет только отвлекать. Устройство защиты, размещённое в моторном отсеке, не
позволит своевременно отреагировать на замыкание анодов на корпус автомобиля,
потому как многие не заглядывают под капот своего коня от одной, до другой
смены масла в двигателе. Поэтому, по моему мнению, оптимальное место
расположения устройства – под приборной панелью, в нише, на 10-20 сантиметров
выше педалей управления. Перед выходом из машины, водитель обычно опускает
глаза для изъятия ключа из замка зажигания, поэтому светодиоды устройства
защиты окажутся в поле его зрения. А красный горящий светодиод обязательно
привлечёт внимание.
Необходимо, чтобы устройство оставалось подключенным к аккумулятору даже при
отключенном общем электрооборудовании автомобиля (выключенном зажигании). В
простейшем случае устройство можно расположить на небольшой изоляционной
пластине (гетинакс, текстолит, пластмасса). Лучший вариант, если устройство
поместить в какую-либо изолированную коробочку, или залить эпоксидной смолой.